


Culture cellulaire : quelles cellules et comment les manipuler ?
1. Considérations préalables
On sous entend par culture cellulaire la mise en oeuvre de cultures de cellules issues d'organismes multicellulaires.
Réaliser une culture cellulaire, c'est pratiquer un ensemble de techniques biologiques pour multiplier ces cellules le plus souvent hors de leur organisme d'origine (in vitro) et les utiliser comme support pour ces expérimentations.
Il faut donc avoir un projet nécessitant ce support très particulier et très contraignant : étude de molécules ou d'agents cytotoxiques, amplification de virus...
Pourquoi ces cellules représentent-elles un danger ?
2. Types de cellules
2.1 Origine des cellules
Elles sont prélevées à partir de sang, de tissus ou organes humains, animaux ou végétaux.
2.2 Différentes cultures
Sont distinguées :
3. Technique employée pour le passage
Le passage est le nom donné à l'ensemble des manipulations qui permettent de passer d'une culture arrivée à saturation (nutriments et surface épuisés) à une culture jeune qui pourra évoluer durant 2 à 3 jours.
Ces gestes très nombreux et spécialisés sont réalisés en grande partie sous PSM pour garantir la non contamination du produit mais aussi pour garantir au manipulateur une sécurité microbiologique.
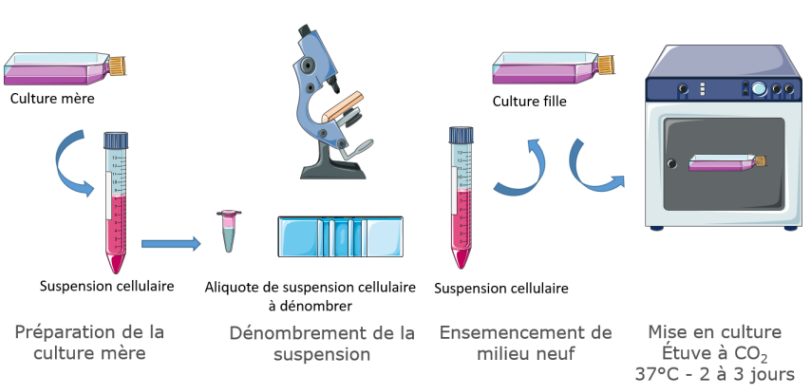
3.1. Préparation de la culture mère
Après vérification de la viabilité et de la non contamination de la culture mère au microscope inversé, il convient de décoller les cellules du support par l'ajout de trypsine après élimination du milieu usagé et rinçage de la couche cellulaire (enlèvement des cellules non fixées et des neutralisants de la trypsine dont l'alpha1 antitrypsine présent dans le sérum de veau foetal, additif indispensable à la croissance des cellules).
L'ajout de la trypsine, enzyme protéolytique, permet de catalyser les réactions d'hydrolyse des liaisons matrice - cellule et cellule - cellule. Cette action est favorisée par la chaleur (37 °C) et l'agitation. Cette action est suivie régulièrement au microscope inversé jusqu'à ce que les cellules apparaissent isolées et détachées de la plaque.
Il convient d'arrêter l'action de la trypsine par l'ajout d'un volume de milieu de culture (contenant du sérum de veau foetal).
3.2. Dénombrement
Les cellules sont dénombrées en hématimètre afin d'estimer leur pourcentage de viabilité (ajout d'un colorant différenciant les cellules mortes et celles viables) et leur concentration.
3.3. Ensemencement d’un milieu neuf
Un volume de suspension cellulaire est ajouté à du milieu complémenté afin d'obtenir une concentration adaptée permettant la croissance des cellules sur le support durant 2 à 3 jours sans chevauchement.
Le flask est ensuite mis à incuber dans une étuve thermostatée contenant une atmosphère enrichie en CO2.
5. Ressources et références